Les phospholipides et le cholestérol sont deux composants importants de la membrane cellulaire. Ils jouent un rôle essentiel dans le transport transmembranaire cellulaire, la transmission du signal et le métabolisme biologique. Mais quelles sont leurs interactions? Dans cette revue de littérature, nous partagerons un article sur l'analyse des interactions entre phospholipides et cholestérol (CHOL) en utilisant deux moyens: la diffusion et la simulation de dynamique moléculaire. On espère que cela améliorera non seulement notre compréhension de la structure de la membrane cellulaire, mais apportera également des inspirations au développement des liposomes et des nanoparticules lipidiques.
 Résumé:
Résumé:
Le cholestérol et les phospholipides sont omniprésents dans les membranes cellulaires des mammifères et leurs interactions sont essentielles dans le trafic de cholestérol médié par les lipides. Les interactions entre le cholestérol et les phospholipides ont été déterminées en combinant la diffusion des neutrons aux petits angles (SANS), la diffusion des rayons X aux petits angles (SAXS) et la dynamique moléculaire (MD) simulation de l'atome entier.
Modélisation: Le modèle de distribution de densité de diffusion des bicouches composées de cholestérol et de lipides d'éther a été construit, et les paramètres structurels de diverses membranes bicouches ont été obtenus.
Simulation: Des simulations de dynamique moléculaire avec des contraintes de surface ont été effectuées et les données expérimentales ont été reproduites. Cette approche analytique itérative a abouti à un bon accord entre les structures expérimentales et simulées, et les interactions moléculaires entre le cholestérol et les phospholipides ont été vérifiées par des simulations MD.
Conclusion: · En présence d'éther lipide, le groupe hydroxyle (-OH) du cholestérol forme principalement des liaisons hydrogène avec le groupe phosphate sur la tête phospholipidique. En présence de phospholipide, le groupe hydroxyle du cholestérol forme des liaisons hydrogène avec le groupe carbonyle sur la chaîne grasse phospholipidique. En résumé, le cholestérol se rapproche de la surface de la bicouche lorsque des lipides éther sont présents et provoque la déshydratation des groupes phosphate dans la tête. De plus, la distribution de densité spatiale tridimensionnelle autour du cholestérol suggère qu'il subit un emballage de chaîne anisotrope, entraînant une inclinaison du cholestérol.
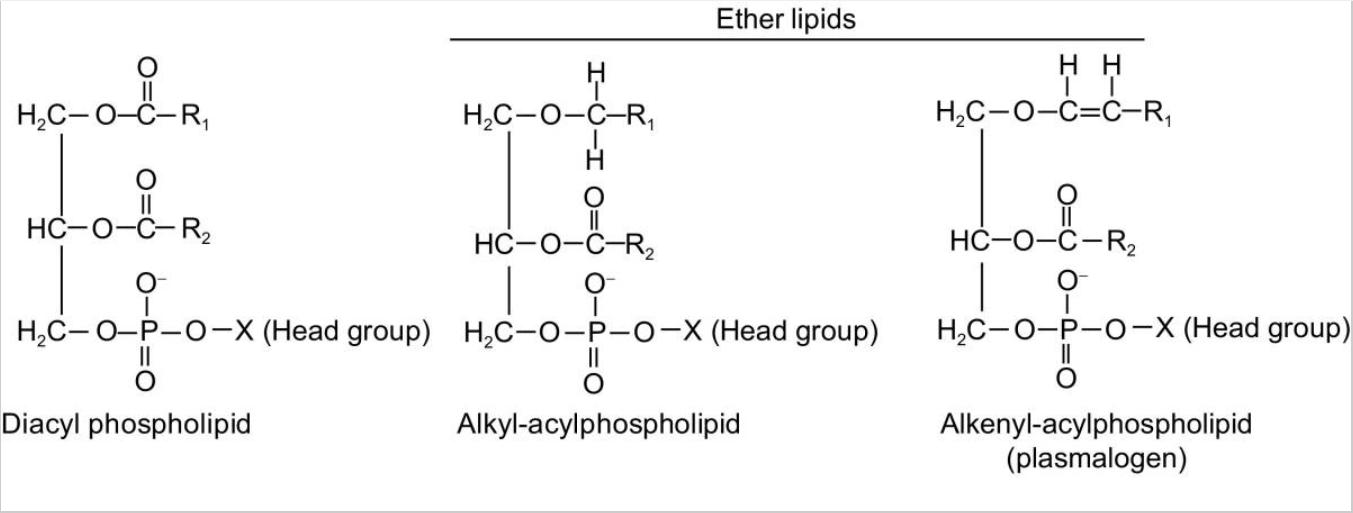
Fig. 1. Structures moléculaires des phospholipides et des lipides éther
Matériel:
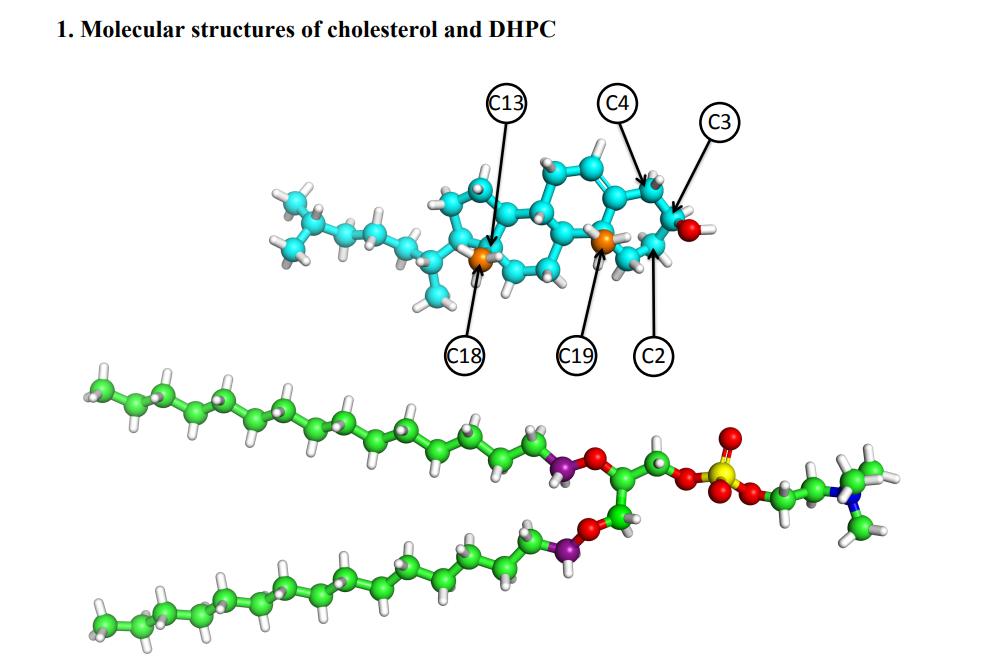
Fig. 2. Structures moléculaires du cheolestérol (CHOL) et de la dihexadécylphosphatidylcholine (DHPC)
Le modèle construit est une bicouche lipidique composée de cholestérol (CHOL) et de dihexadécylphosphatidylcholine (DHPC). Les images atomiques du modèle de distribution de densité de diffusion (SDP) ont d'abord été obtenues par simulation MD sans application de tension superficielle, puis différents paramètres structurels (zone lipidique, épaisseur de couche hydrophobe bicouche, etc.) ont été déterminés, et le modèle a ensuite été optimisé en analysant les données expérimentales. La simulation de MD a été réalisée sur la tension superficielle au stade ultérieur, et les interactions moléculaires entre le cholestérol et les différents lipides ont été analysées plus en détail en comparant les résultats de la simulation avec les résultats des tests.
Diffusion de neutrons à petit angle (SANS):
Les tests à neutrons ont été effectués à l'aide de la source de neutrons épars (SNS) BL-6 EQ-SANS au laboratoire national d'Oak Ridge. Le vecteur de diffusion total Q (0.03 < Q < 0.8 Â-1) A été calculé à l'aide d'un détecteur à une plage de waVelengths (2.5-6.0 Â), avec une distance entre le détecteur et l'échantillon de 2.0 m. À l'aide d'un logiciel fourni par SNS pour la correction et la réduction du bruit, des intensités unidimensionnelles (1D) ont été obtenues par analyse de données.
Diffusion des rayons X à petit angle (SAXS):
Les données radiographiques ont été collectées à partir du G-1 Cornell High Energy Synchrotron Source. Le coupleur de charge FLICAM (taille linéaire de 71 µm, tableau de pixels de 1,024 «1,024») a été utilisé pour détecter la diffusion à partir d'un faisceau incident collimaté (0.24 de se 0.24mm2) Éclairé par des rayons X à une longueur d'onde de 1.17 Â sur des échantillons ULV. La distance entre l'échantillon et le détecteur était de 505.8mm. L'échantillon a été transféré dans un tube capillaire de quartz de 1.5mm et placé dans un rack à température contrôlée. La relation entre l'intensité de diffusion I et le vecteur de diffusion Q a été obtenue en soustrayant de fond la moyenne radiale de données bidimensionnelles (2D). Il est ensuite converti en un facteur de forme de rayons X en utilisant la même relation que les neutrons.
Simulation de dynamique moléculaire (MD):
CHARMM-GUI Membrane Builder a été utilisé pour générer des coordonnées pour une bicouche DHPC pure (128 DHPC) et une bicouche DHPC avec 20 mol % de cholestérol (128 DHPC 32CHOL).
Étant donné que l'éther lipide DHPC n'était pas inclus dans la sélection des lipides des CHARMM-GUI, il était nécessaire de construire d'abord le modèle de bicouche DPPC à l'aide de CHARMM-GUI, puis de changer le groupe carbonyle (C = O) dans le groupe DPPC en méthylène (CH2) Dans DHPC. Le système a été solvaté en ajoutant des molécules d'eau à 4,300 4,800, tandis que suffisamment de NaCl a été introduit pour l'équilibre des charges. Le package NAMD (version 2.816) et le champ de force lipidique CHARMM 36 ont été utilisés pour les simulations MD. Pour une optimisation spécifique du champ de force et des paramètres MD, reportez-vous au texte d'origine ainsi qu'aux pièces justificatives.
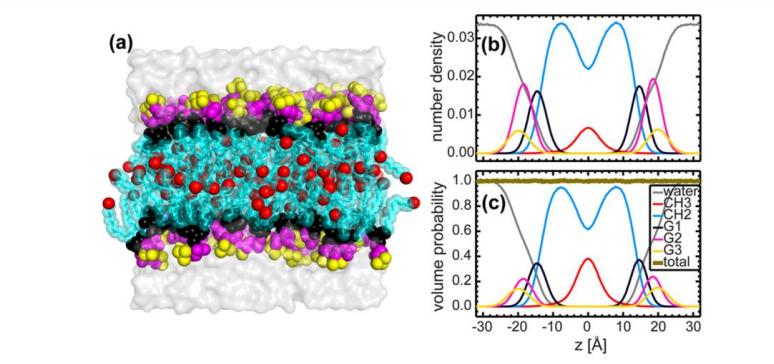
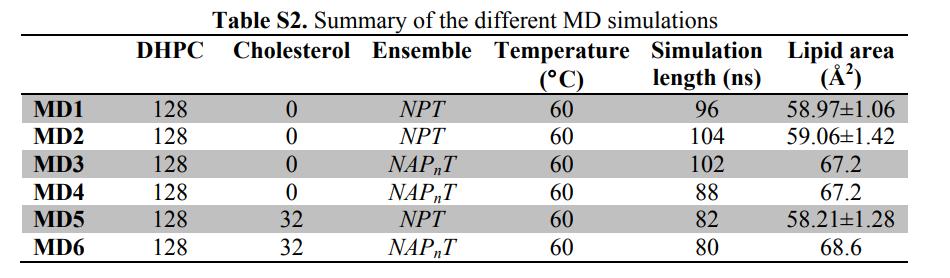
Fig. 3. Système de simulation MD et construction du système bicouche DHPC
(A) Systèmes bicouches équitables dans lesquels la bicouche lipidique est résolue en cinq composants (différenciation des couleurs): rouge-méthyle (CH3); Liaison éther du squelette noir-glycérol; bleu clair-méthylène (CH2); Groupe de tête pourpre (radical phosphate + CH2CH2N); et triméthyle terminal jaune-choline.
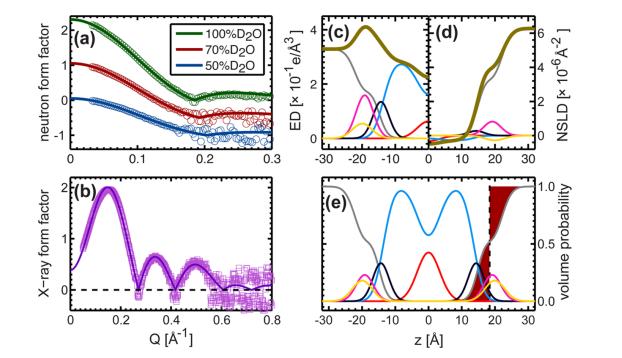
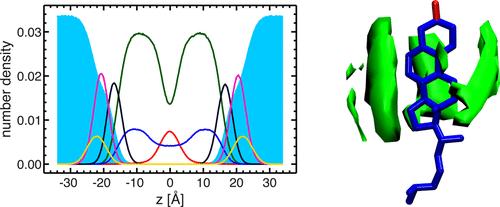
Fig. 4. Élucidation des modèles SDP par différents facteurs expérimentaux comparatifs
(La composition lipidique est décrite par des fonctions analytiques (c.-à-d. Fonction gaussienne et fonction d'erreur), et la teneur en eau est déterminée par complémentation avec l'intégrale totale du liposome. A: diffusion neutronique; b: diffusion des rayons X; c: densité électronique totale; d: densité de longueur de diffusion neutronique; e: distribution de volume. Remarque: La description de la couleur est conforme à la figure 3)
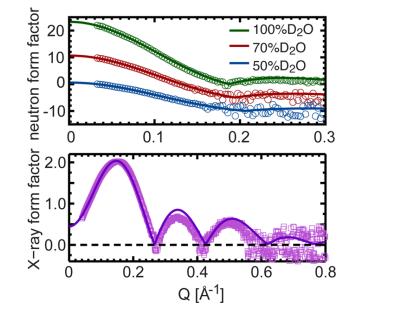
Fig. 4. Comparaison directe entre les facteurs de forme des neutrons et des rayons X pour différentes expériences de contraste
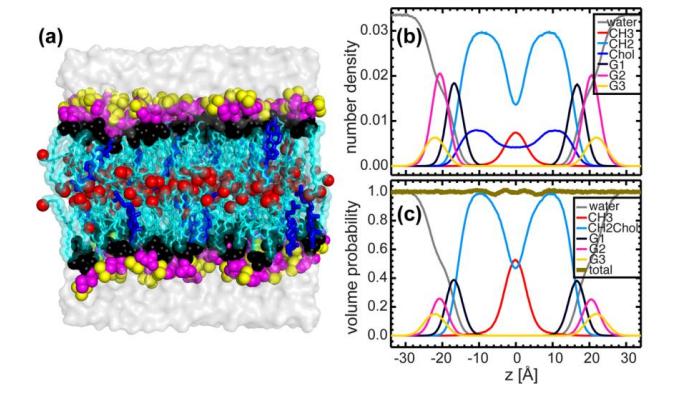
Fig. 5. Simulation MD d'une bicouche contenant 20 mol % de cholestérol et DHPC
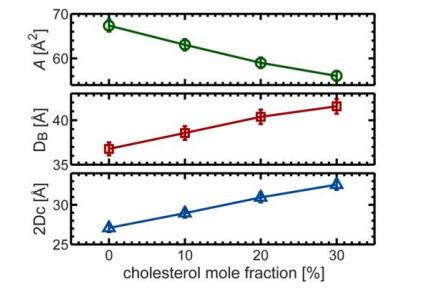
Fig. 6. Concentration de cholestérol par rapport aux changements des paramètres structurels représentatifs des bicouches DHPC
(L'effet d'ordre du cholestérol est démontré par une diminution de la surface lipidique avec une augmentation de la concentration de cholestérol, une augmentation de l'épaisseur de la bicouche de membrane lipidique DBEt épaisseur 2D d'hydrocarbureC, Et un changement approximativement linéaire de l'effet d'agrégation du cholestérol.)
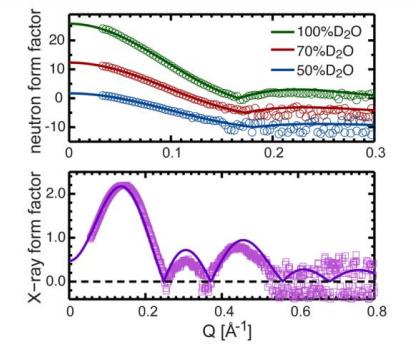
Fig. 7. Comparaison directe entre différents facteurs de forme expérimentaux pour les membranes bicouches DHPC constituées de 20 mol % de cholestérol et les facteurs de forme calculés par simulation cinétique NAPnT au niveau de la zone cellulaire de l'unité fixe
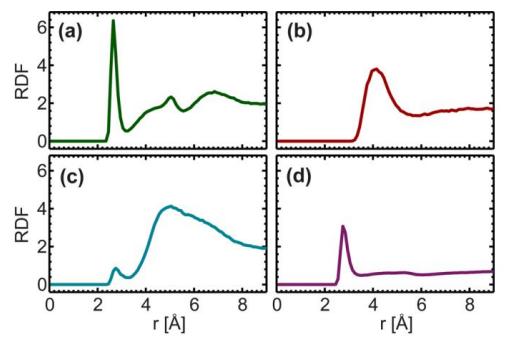
Fig. 8. Fonction de distribution radiale du groupe hydroxyle (-OH) du cholestérol avec le radical phosphate (a), l'atome N de choline (b), le groupe éther de chaîne principal (-O-, c), et l'atome d'oxygène dans l'eau libre (un pic net a été observé pour le radical phosphate et l'eau à 2.7 Â, Et un pic large a été observé pour l'atome N dans la choline à 4 Â.)
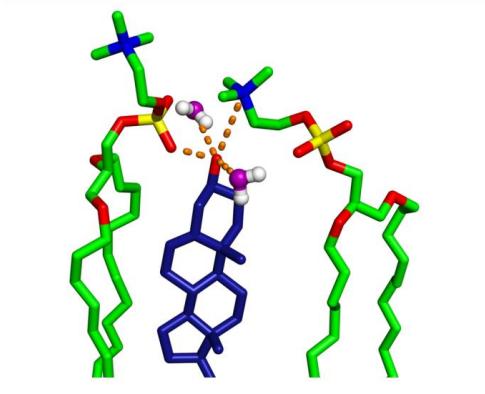
Fig. 9. Liaison hydrogène entre les CHOL-OH et les lipides voisins sur la base de la distribution RDF de la figure 8. (Orange indique les liaisons hydrogène potentielles et les interactions électrostatiques.)
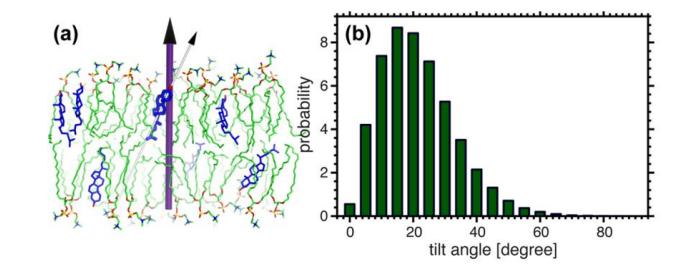
Fig. 10. Obligation du tétraloop planaire du cholestérol par rapport à la normale de la bicouche. Le cholestérol n'est pas distribué verticalement dans la membrane, mais avec un certain angle. La grande majorité du cholestérol a une distribution d'inclinaison de 20 °.
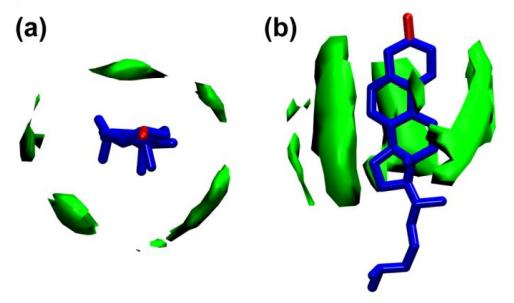
Fig. 11. Distribution de densité 3D des chaînes hydrocarbonées aliphatiques près du cholestérol. L'emballage de chaîne anisotrope est associé aux tétraloops de cholestérol, et l'emballage de chaîne à haute densité se produit également près de la face lisse de l'anneau.
Conclusion:
Cette étude a combiné des expériences avec des simulations. SANS et SAXS ont été utilisés pour étudier la position moléculaire et l'orientation du cholestérol dans les bicouches de lipides éther. Les causes des différentes propriétés de diffusion des bicouches ont été analysées plus en détail par des simulations MD, qui ont formé la base du modèle SDP pour l'analyse des données expérimentales. En revanche, les paramètres du modèle ont été optimisés en utilisant les paramètres structurels obtenus expérimentalement pour améliorer l'authenticité et la fiabilité des simulations MD et déterminer les interactions moléculaires entre le cholestérol et les lipides éther. Les interactions moléculaires entre les acylphospholipides ordinaires et le cholestérol en sont une autre.
Plus précisément:
Dans les bicouches composées d'éther lipides, le groupe hydroxyle (-OH) sur le cholestérol forme des liaisons hydrogène avec l'oxygène dans les groupes phosphate, tandis que dans les phospholipides ordinaires, les groupes hydroxyle ont tendance à former des liaisons hydrogène avec des groupes carbonyle (C = O) sur les graisses phospholipides en raison duPrésence de groupes d'ester. Cette différence dans les interactions peut expliquer le rôle important que jouent les phospholipides acétal (lipides éther) dans la médiation du transport du cholestérol. Plus important encore, dans la présente étude, les interactions entre différentes molécules dans l'environnement membranaire ont été davantage modulées en modifiant la composition chimique des lipides.
Cholestérol, y comprisCholestérol HP, Joue un grand rôle dans les organismes et est également un excipient pharmaceutique important. L'AVT fournit du cholestérol d'origine végétale. Contactez-nous pour plus d'informations.
Références:
[1]. Dean JM, Lodhi IJ.Rôles structurels et fonctionnels des lipides d'éther.Cellule protéique. 2018;9(2):196-206. doi:10.1007/s13238-017-0423-5
[2]. Pan J, Cheng X, Heberle FA, Mostofian B, Kučerka N, Drazba P, Katsaras J. Interactions entre les éther phospholipides et le cholestérol telles que déterminées par des simulations de diffusion et de dynamique moléculaire. J Phys Chem B. 2012 Dec 27;116(51):14829-38. Doi: 10.1021/jp310345j. Epub 2012 13 déc. PMID: 23199292; PMCID: PMC3539752.