Dans les trois premiers numéros, nous avons partagé les études du D ()-dihydrate de tréhalose dans la cryoprotection des cellules précurseurs d'oligodendrocytes humains (OPC), des cellules souches dérivées d'adipeux (ADSC), cellules germinales testiculaires de souris, etc. Ces études ont révélé que l'ajout d'une quantité appropriée de D ()-tréhalose dihydraté au milieu de cryoconservation ou l'utilisation d'un cryoprotecteur (CPA) Contenant du D ()-tréhalose dihydraté et du glycérol peut améliorer le taux de récupération des cellules après une cryoconservation à long terme.
Dans ce numéro, nous développons une compréhension claire de l'effet cryoprotecteur du D ()-tréhalose dihydraté dans trois lignées de cellules souches pluripotentes humaines différentes à travers un article publié dans leRecherche sur les cellules souchesEn 2018 par des chercheurs de Milan, Italie.
Cryoconservation des cellules souches pluripotentes humaines avec D ()-tréhalose dihydraté
Les produits de thérapie cellulaire, y compris les cellules souches, ont un potentiel clinique élevé. Le marché mondial des cellules souches implique le stockage et la préparation de cellules souches en amont et intermédiaire ainsi que des applications cliniques en aval. Selon le rapport de Transparency Market Research (TMR), le marché mondial des cellules souches devrait atteindre 270.5 milliards de dollars d'ici la fin de 2025, et le taux de croissance annuel composé du marché est en passe d'atteindre 13.8% au cours des 8 dernières années.
Pour assurer l'application réussie des produits de thérapie cellulaire, la cryoconservation à long terme des cellules est une difficulté technique qui doit être vaincue car la cryoconservation est la seule méthode disponible pour la préservation à long terme de la viabilité et de la fonction biochimique des cellules.
Afin d'éviter d'endommager les structures cellulaires causées par la congélation intracellulaire, des cryoprotecteurs sont développés et commercialisés. Les cryoprotecteurs cellulaires les plus couramment utilisés sont le diméthylsulfoxyde (DMSO) en association avec du sérum bovin fœtal (FBS) ou tout substitut sérique.
Cependant, le FBS contient des protéines animales xénogènes qui peuvent provoquer des infections zoonotiques avec des agents pathogènes inconnus. De plus, le DMSO est cytotoxique. Il est rapporté que la toxicité du DMSO sur les tissus et les cellules est directement liée au temps d'exposition, à la température et à la concentration. Le degré de toxicité varie selon le type de cellule et des effets indésirables ont été rapportés chez des patients réinjectés avec des cellules décongelées sans éliminer le DMSO. De plus, le DMSO est connu pour affecter l'épigénome des embryoïdes de souris en régulant les niveaux de transcription de trois ADN méthyltransférases (Dnmts) et en modifiant les profils de méthylation à l'échelle du génome, qui à son tour conduit à une différenciation incontrôlée des cellules souches de souris. Pour toutes ces raisons, le DMSO FBS ne convient pas à un usage clinique. Il est urgent de développer des cryoprotecteurs efficaces et non toxiques.
Le dihydrate de D ()-tréhalose est un disaccharide non réducteur trouvé dans une variété d'organismes capables de survivre à une déshydratation complète, tels que les bactéries, les levures, les tardigrades et les nématodes. Les mammifères ne produisent pas de dihydrate de D ()-tréhalose, mais c'est un cryoprotecteur efficace des cellules de mammifères, qui peut réduire les dommages cellulaires causés par la formation de cristaux de glace. L'effet protecteur du D ()-tréhalose dihydraté est lié à l'effet osmotique et à l'interaction spécifique des phospholipides membranaires cellulaires et des protéines labiles, qui peut empêcher les dommages cellulaires et la dénaturation en raison de la dessiccation et du stress oxydatif.
Le dihydrate de D ()-tréhalose non cytotoxique a été utilisé efficacement pour la cryoconservation de différents types de cellules telles que les spermatocytes de souris, les cellules souches hématopoïétiques adultes, les cellules souches mésenchymateuses, les cellules souches dérivées d'adipeux (ADSC), les cellules souches embryonnaires humaines (CSEh) et les cellules souches pluripotentes induites par l'homme (hiPSC). Le dihydrate de D ()-tréhalose est également utilisé pour la cryoconservation du sang de cordon, de la moelle osseuse et des îlots humains.
Le principal obstacle à l'utilisation généralisée du dihydrate de D ()-tréhalose dans la préservation cellulaire est qu'il est difficile pour le D ()-tréhalose dihydraté d'accéder à l'intérieur de la cellule. Plusieurs moyens ont été appliqués précédemment pour résoudre le problème, tels que le choc osmotique, la délivrance de liposomes, la perforation thermique, l'électroporation, la microinjection et le génie génétique. Cependant, les méthodes ci-dessus nécessitent des opérations complexes, sont laborieuses et prennent du temps et peuvent entraîner des dommages cellulaires importants.
Dans cette étude, trois types différents de lignées de cellules souches pluripotentes ont été cryopréservés avec quatre cryoprotecteurs différents préparés en utilisant du D ()-tréhalose dihydraté seul ou en association avec de l'éthylène glycol ou du glycérol, respectivement. Les lignées cellulaires ont ensuite été décongelées pour étudier les paramètres clés, notamment la morphologie cellulaire, la viabilité post-dégel, les niveaux d'expression des marqueurs de pluripotence, la stabilité génomique, l'homéostasie du réticulum endoplasmique (ER) et la réponse aux dommages à l'ADN, mesure du capuchon cryoprotecteurAcité des quatre cryoprotecteurs sur les cellules souches pluripotentes.
Différentes compositions cryoprotectrices
Groupe | Composante |
A | 0.5 M D(+)-tréhalose dihydraté |
B | 0.5 M D(+)-tréhalose dihydraté + éthylène glycol 2.5% |
C | 0.5 M D(+)-tréhalose dihydraté + éthylène glycol 10% |
D | 0.5 M D(+)-tréhalose dihydraté + glycérol 10% |
Tous les cryoprotecteurs étaient fraîchement préparés et dilués dans une solution saline tamponnée au phosphate (PBS). Les cellules utilisées dans l'étude étaient cryopréservées à l'aide de CS10. CS10 contenant 10% DMSO est un cryoprotecteur sans composant sérique et animal, qui est recommandé pour la cryoprotection des cellules souches pluripotentes humaines (hPSC).
Culture les cellules dans des conditions spécifiques. Dissociez les hESCs-RC17 avec de l'EDTA 0.5 mM, traitez les hiPSCs-CTR2 n ° 6 et ltNES-AF22 avec des solutions de détachement cellulaire et stockez-les dans des cryoprotecteurs fraîchement préparés (A, B, C et D). Réussir 2.0 cellules × 10 ^ 6 dans 1.5 mL de chaque cryoprotecteur et transférer dans des flacons cryogéniques.
Refroidir les flacons cryogéniques dans un récipient de congélation à environ-1 ℃/min, et transférer dans un congélateur à-80 ℃ après une nuit de stockage. Après 24 h, transférer les flacons cryogéniques dans de l'azote liquide pour les conserver pendant au moins une semaine.
Réchauffez les flacons cryogéniques dans un bain-marie à 37 ℃ jusqu'à ce que la masse de glace disparaisse et diluez la suspension cellulaire avec du milieu chaud. Recueillir les cellules de 200g de tissu par centrifugation pendant 3 min et ensemencer sur des vaisseaux de culture enrobés appropriés pour chaque type de cellule à la taille indiquée d'inoculum.
① Viabilité cellulaire
Mesurer la viabilité cellulaire avec l'agent alamarBlue 48 h après décongélation.
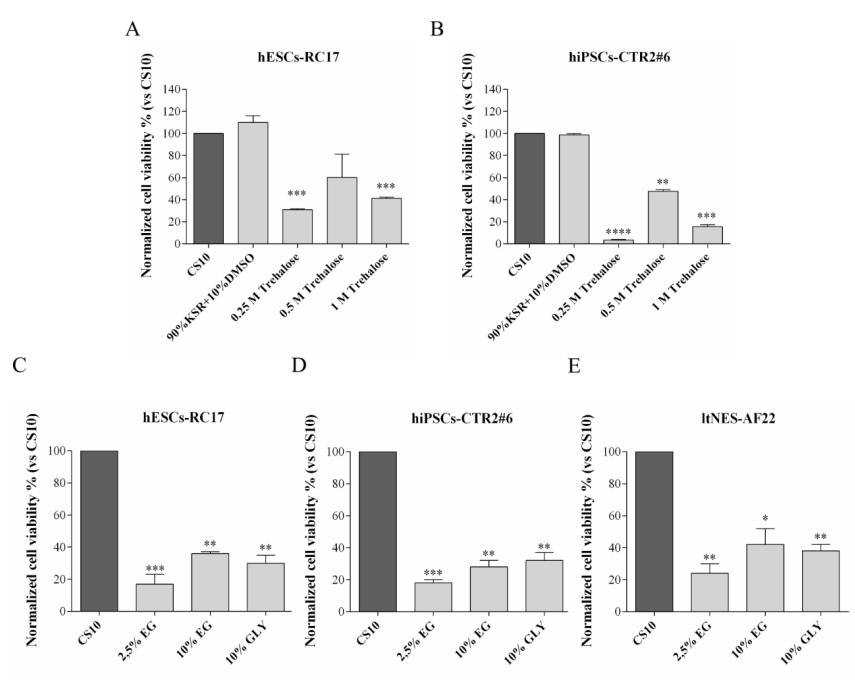
Premièrement, pour déterminer la quantité appropriée de dihydrate de D ()-tréhalose, d'éthylène glycol et de glycérol, différentes concentrations de solutions à un seul composant ont été utilisées pour différentes lignées de cellules souches. La viabilité des cellules après décongélation a été mesurée et comparée aux groupes témoins. Les résultats ont montré que 0.5 M D ()-tréhalose dihydraté, l'éthylène glycol 10% et le glycérol 10% étaient des quantités appropriées, mais il y avait de grandes différences entre les différents types de cellules souches.
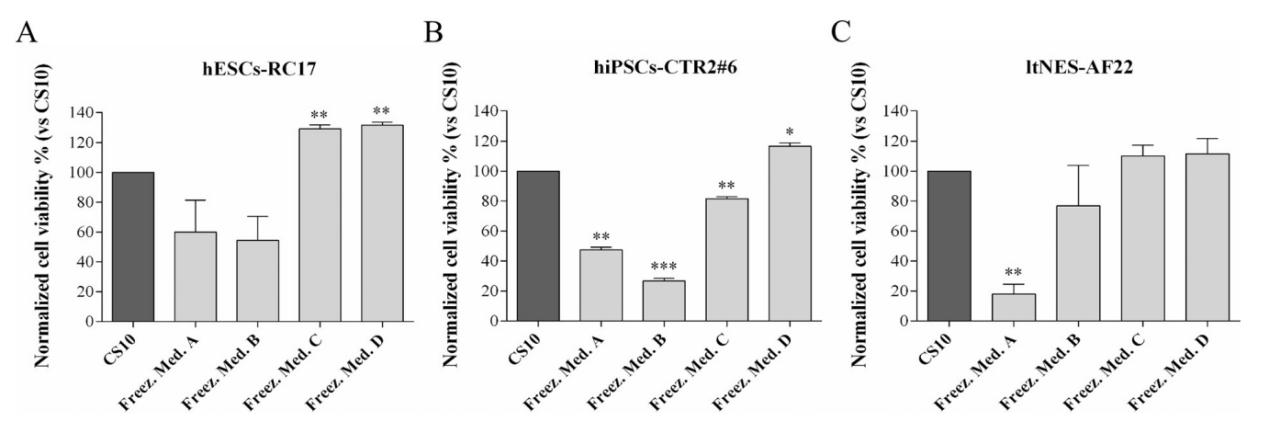
Après avoir déterminé la concentration initiale, quatre cryoprotecteurs différents (voir ci-dessus) ont été utilisés pour la cryoconservation de trois lignées de cellules souches: (groupe A) hESCs-RC17, (groupe B) hiPSCs-CTR2 n ° 6, et (Groupe C) ltNES-AF22. La viabilité des cellules a été mesurée après décongélation. Le taux de survie cellulaire a également été comparé aux mêmes cellules cryopréservées dans CS10 dans les mêmes conditions.
Lorsque les cellules étaient cryoconservées avec du D ()-tréhalose dihydraté uniquement (groupe A), le taux de récupération des cellules après décongélation a diminué, variant de 20% à 60% pour différents types de cellules.
Lorsque le milieu à base de D ()-tréhalose dihydraté était complété par de l'éthylène glycol 10% ou du glycérol 10% (groupes C et D), les taux de survie cellulaire des hESCs-RC17 et des ltNES-AF22 ont atteint des niveaux similaires à ceux cryoconservés dans le DMSO. Cependant, le taux de survie cellulaire du hiPSCs-CTR2 n ° 6 cryoconservé dans le glycérol était meilleur que celui de l'éthylène glycol.
De plus, en comparant les résultats avec des cryoprotecteurs témoins contenant de l'éthylène glycol ou du glycérol seul, il a été confirmé que l'augmentation du taux de survie était due à l'effet combiné de l'éthylène glycol/glycérol D ()-tréhalose dihydraté.
Ces résultats suggèrent que le D ()-tréhalose dihydraté peut être utilisé pour la cryoconservation des cellules souches pluripotentes humaines et devrait remplacer le DMSO, et l'ajout d'éthylène glycol 10% ou de glycérol 10% peut améliorer considérablement le taux de survie des cryoprotecteurs du tréhalose. Le taux de survie cellulaire moyen a été augmenté par rapport à CS10. Les cryoprotecteurs de l'éthylène glycol/glycérol et du D ()-tréhalose dihydraté ne contiennent pas de protéines sériques et évitent le risque précédemment rapporté de stimuler la différenciation prématurée des cellules souches pluripotentes.
② Morphologie cellulaire
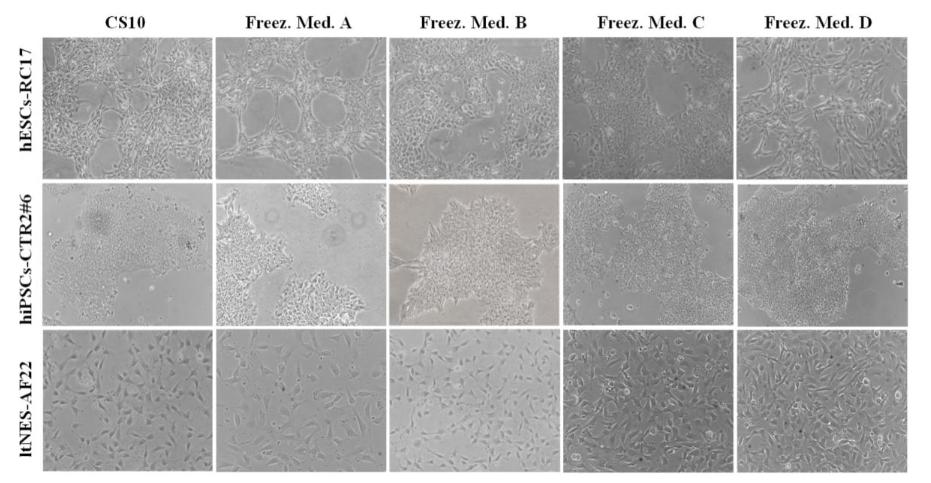
Une autre préoccupation avecLa cryoconservation des cellules souches est une altération chromosomique et pluripotence. Pendant la congélation et la décongélation, des cristaux de glace et des bulles peuvent se former à l'intérieur et à l'extérieur des cellules, perturbant les microtubules du fuseau pour induire une ségrégation chromosomique anormale et entraînant des changements dans les caractéristiques de croissance cellulaire et la morphologie. Par conséquent, la possibilité d'endommagement du chromosome et du potentiel pluripotent des cellules souches peut être facilement évaluée en observant la morphologie des cellules après décongélation.
La figure supérieure montre la morphologie cellulaire de hESCs-RC17, hiPSCs-CTR2 #6 et ltNES-AF22 48 h après la décongélation. Les images de contraste de phase ont montré que les cryoprotecteurs composites D( )-tréhalose dihydraté ne provoquaient aucun changement morphologique significatif dans aucune des lignées cellulaires et que la morphologie cellulaire était identique à celle des cellules conservées dans CS10.
③ Niveau d'expression du marqueur
Pour confirmer que hESCs-RC17, hiPSCs-CTR2 n ° 6 et ltNES-AF22 après décongélation ont conservé les propriétés et caractéristiques clés des cellules souches pluripotentes, les niveaux d'expression de plusieurs marqueurs ont été analysés par RT-PCR quantitative 48 h après la décongélation.
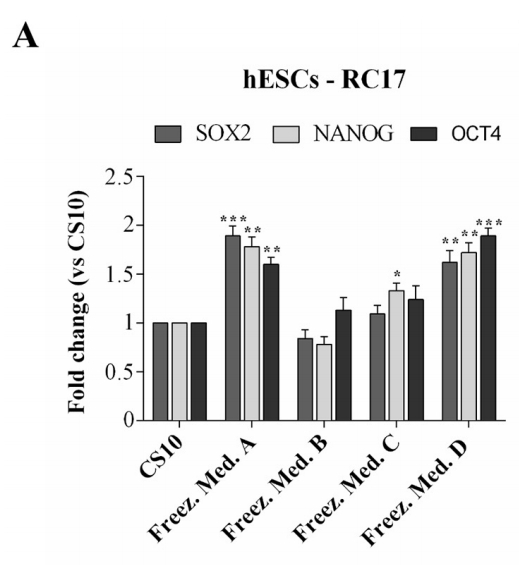
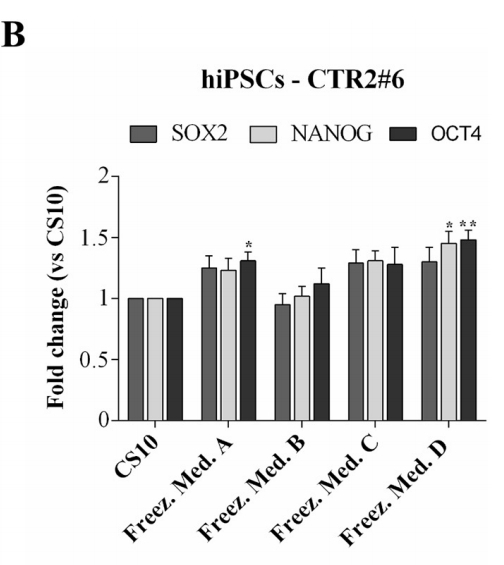
Les marqueurs cellulaires Nanog, Oct4 et Sox2 ont été détectés pour hESCs-RC17 et hiPSCs-CTR2 #6, et comparés aux groupes témoins.
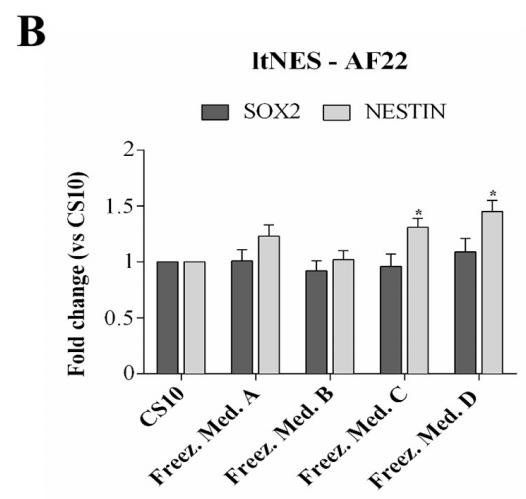
Nestin et Sox2 ont été détectés pour ltNES-AF22 et comparés à des groupes témoins. Les résultats ont montré que le potentiel de différenciation des cellules souches n'était pas affecté.
④ Stabilité des chromosomes
Pour évaluer l'effet des cryoprotecteurs à base de dihydrate de D( )-tréhalose sur la stabilité du chromosome dans les cellules souches, le caryotypage conventionnel et l'aCGH ont été réalisés sur les trois lignées de cellules souches. La figure ci-dessous montre les résultats des ltNES-AF22 avant et après la cryoconservation.
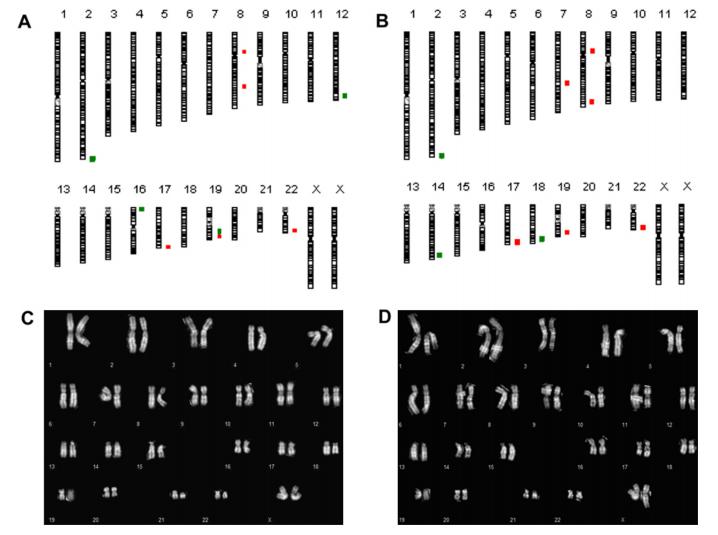
Dans l'ensemble, les caryotypes sont restés stables, mais des variations du nombre de copies (CNV) ont été détectées (chromosomes 2, 8, 19 et 22). Certains des CNV peuvent avoir été présents dans les cellules primaires et d'autres peuvent être apparus au hasard lors de la manipulation in vitro des cellules plutôt que de la cryoconservation, car aucune aneuploïdie clonale ou aberration structurale des chromosomes n'a été observée avant (figure C) et après (figure D) la cryoconservation.
⑤ Stress ER/évaluation du niveau de protéines déplié
L'étude s'est également concentrée sur la question de savoir si la cryoconservation dans CS10 ou D( )-dihydrate de tréhalose affectait la capacité des cellules pluripotentes à répondre au stress du réticulum endoplasmique (ER) et à activer la réponse protéique dépliée (UPR). Pour maintenir l'homéostasie dans différentes conditions physiologiques ou pathologiques, ER intègre divers signaux moléculaires et cellulaires. Le stress ER et l'UPR interviennent tous deux dans la médiation des mécanismes moléculaires et biochimiques qui affectent la prolifération, la différenciation et l'apoptose des cellules.
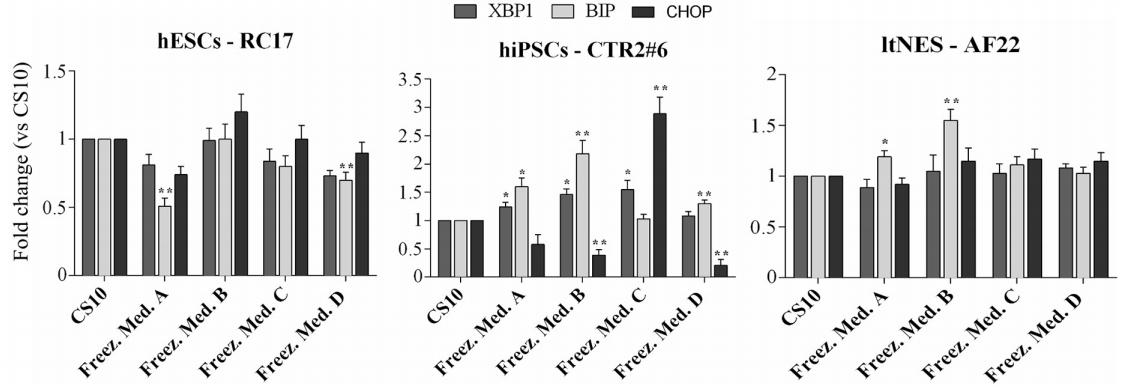
Dans l'ensemble, le D( )-tréhalose dihydraté présentait un niveau modéré de stress ER/UPR par rapport au CS10. La seule lignée cellulaire plus sensible était la hiPSCs-CTR2 n ° 6, qui montrait des niveaux d'expression des gènes BIP et CHOP plus élevés dans les groupes B et C, indiquant que la cryoconservation avec D( )-le tréhalose dihydraté n'a pas modifié de manière significative l'homéostasie ER des cellules souches multipotentes par rapport au CS10.
La cryoconservation à long terme des cellules souches a un grand potentiel d'application dans de nombreux domaines tels que la transplantation cellulaire et la thérapie cellulaire. Plusieurs études ont optimisé les moyens de cryoconservation des cellules souches pluripotentes humaines, et la cryoconservation à long terme avec D( )-dihydrate de tréhalose peut être une méthode idéale.
Les cellules souches pluripotentes humaines préservées dans les cryoprotecteurs D( )-tréhalose dihydraté maintiennent les phénotypes cellulaires et les propriétés fonctionnelles, indiquant les applications potentielles du D( )-tréhalose dihydraté en thérapie clinique. Bien que des études supplémentaires soient nécessaires pour évaluer la biosécurité des cellules cryopréservées avec des cryoprotectants composites D( )-tréhalose dihydraté, la combinaison de D( )-tréhalose dihydraté avec de l'éthylène glycol ou du glycérol, en tant que cryoprotecteur de biosécurité sans cytotoxicité ni protéines d'origine animale, est très prometteur pour les applications cliniques.